可用于测定酸、碱和两性物质,是一种利用酸碱反应进行容量分析的方法。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。标定它们的基准物质是碳酸钠。
酸碱滴定
酸碱滴定法是指利用酸和碱在水中以质子转移反应为基础的滴定分析方法。

实验原理
实验步骤
一、实验目的
1. 了解酸碱强度与溶剂的关系。
2. 掌握分布系数以及处理酸碱平衡的方法。
3. 掌握酸碱平衡中的pH值得计算:掌握酸碱水溶液中氢离子浓度的计算方法(近似式和最简式)。
4. 掌握酸碱滴定的基本原理。掌握酸碱滴定中氢离子浓度的变化规律。重点掌握强酸、强碱相互滴定和强碱滴定弱酸的滴定曲线,既掌握化学计量点及0.1%准确度(滴定突跃),pH值计算。
5. 掌握酸碱指示剂指示终点的原理与选择原则。掌握几种常见缓冲溶液的配置方法,了解缓冲范围和缓冲容量的概念。
6. 掌握准确滴定及分步滴定的条件和分析结果的计算。
7. 了解酸碱滴定法的应用。
二、概述
1. 酸碱平衡研究的内容
(1)由pH值和相关的平衡常数求算各形式的分布分数
(2)由某些形式的浓度和投料组分的浓度测算相关的平衡常数
(3)缓冲溶液的理论及应用
(4)酸碱指示剂、滴定曲线和终点误差
2. 溶液中的酸碱反应与平衡常数
布朗斯特(Bronsted)的质子酸碱理论
共轭酸碱对: 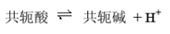
总浓度用c表示,平衡浓度用[ ]表示
酸碱反应的几种类型:
(1)溶剂分子之间的质子转移反应(质子自递反应)
(2)酸碱溶质与溶剂分子间的反应(解离反应)
(3)酸碱中和反应
(4)水解反应
平衡常数的表示方法:
溶液中的反应为 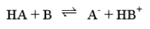
a. 活度常数K0 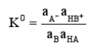
b. 浓度常数Kc 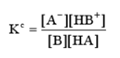
c. 混合常数Kmix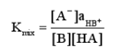
3. 溶液中的其他相关平衡
(1)物料平衡(material balance equation , MBE):在一个化学平衡体系中,某一给定物质的总浓度等于各有关存在形式平衡浓度之和。
(2)电荷平衡(charge balance equation , CBE):溶液中阳离子所带正电荷的量应等于阴离子所带负电荷的量,即电中性原则。
(3)质子平衡(proton balance equation , PBE):酸碱反应中酸失去质子的量等于碱得到质子的量。列出质子条件的步骤:
①选择参考水准:参考水准选择原则:通常是溶液中大量存在的并参与质子转移的物质;
②将得质子的物质列于方程的一边,失质子的物质列于另一边;
③以每种物质相对于参考水准的得(失)质子数作为系数。
质子条件式的特点
①参考水准不出现在PBE中
②只有参与质子转移的型体才包含在条件式中
③得质子产物型体比参考水准的H+多,且多几个H+,浓度前的系数则为几;失质子后产物型体比参考水准的H+少,且少几个H+,浓度前的系数则为几。
三、分布分数
分布分数的定义:溶液中某酸碱组分占总浓度的分数,以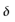 表示,下标i表示某酸碱组分存在形式所具有的质子数(i =0,1,2,...n)。
表示,下标i表示某酸碱组分存在形式所具有的质子数(i =0,1,2,...n)。
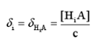
1.一元酸溶液
如HAc,在水溶液中存在如下的电离平衡: ![]()
共有两种型体 
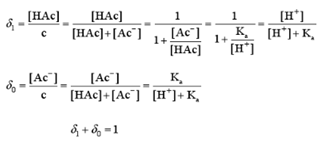
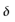 的大小取决于酸碱的Ka(或Kb)及溶液[H+],与总浓度c无关。
的大小取决于酸碱的Ka(或Kb)及溶液[H+],与总浓度c无关。
分布特征:
①pH=pKa时,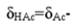 ,有[HAc]=[Ac-]。
,有[HAc]=[Ac-]。
随着pH值增大, 在此点呈下降趋势,
在此点呈下降趋势,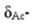 在此点呈上升趋势,
在此点呈上升趋势, 和
和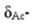 的变化率相等。一元酸(碱)型体分布图以pH=pKa为分界点,分为共轭酸(HAc)型体主要存在区(pH<pKa)和共轭碱(Ac-)型体主要存在区(pH>pKa)。
的变化率相等。一元酸(碱)型体分布图以pH=pKa为分界点,分为共轭酸(HAc)型体主要存在区(pH<pKa)和共轭碱(Ac-)型体主要存在区(pH>pKa)。
②pH<pKa-1时,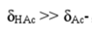 ,有[HAc]≈c。
,有[HAc]≈c。
③pH>pKa+1时,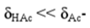 ,有[Ac-]≈c。
,有[Ac-]≈c。
④pKa-1<pH<pKa+1时,为HAc和Ac-的共存区。
对于一元弱碱,可以转化成其共轭酸来处理。
2.多元酸溶液
二元酸如H2C2O4 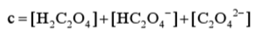
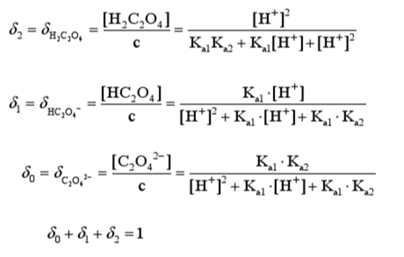
结论
(1)总浓度和平衡浓度是相互联系却又完全不同的概念,两者存在着一定的关系。
(2)对于任何酸碱性物质,满足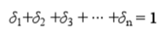
(3)分布分数的大小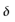 取决于酸碱的Ka(或Kb)及溶液的[H+],与总浓度c无关。
取决于酸碱的Ka(或Kb)及溶液的[H+],与总浓度c无关。
(4)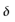 大小能定量说明某型体在溶液中的分布,由
大小能定量说明某型体在溶液中的分布,由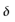 可计算某型体的平衡浓度。
可计算某型体的平衡浓度。
实验交流
共享应用
-
浏览量 3837
-
点赞数 0
-
收藏数 1
课程评分
课程回复
-
评论数 0

