乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的0.3%即可。
乙酸乙酯的制备
1、掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。
2、掌握分馏的原理及分馏柱的作用。
3、进一步练习并熟练掌握液体产品的纯化方法。

实验原理
实验步骤
一、实验目的
1、掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。
2、掌握分馏的原理及分馏柱的作用。
3、进一步练习并熟练掌握液体产品的纯化方法。
二、实验原理
乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的0.3%即可。其反应为:
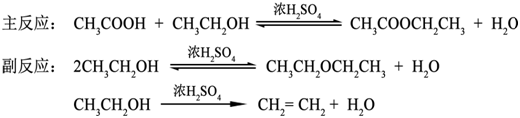
三、试剂及物理常数
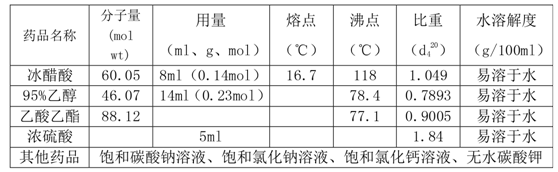
四、实验装置图
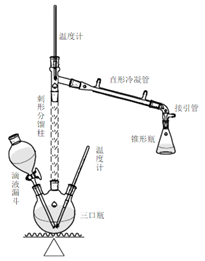
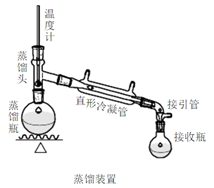
五、实验流程图
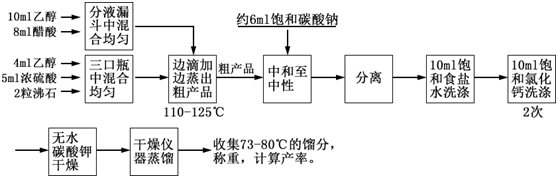
六、实验步骤
在100ml三颈瓶中,加入4ml乙醇,摇动下慢慢加入5ml浓硫酸,使其混合均匀,并加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以下,中间口安一长的刺形分馏柱(整个装置如上图)。
仪器装好后,在滴液漏斗内加入10ml乙醇和8ml冰醋酸,混合均匀,先向瓶内滴入约2ml的混合液,然后,将三颈瓶在石棉网上小火加热到110—120℃左右,这时蒸馏管口应有液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维持反应温度在110—125℃之间,滴加完毕后,继续加热10分钟,直至温度升高到130℃不再有馏出液为止。
馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸等,在摇动下,慢慢向粗产品中加入饱和的碳酸钠溶液(约6ml)至无二氧化碳气体放出,酯层用PH试纸检验呈中性。移入分液漏斗中,充分振摇(注意及时放气!)后静置,分去下层水相。酯层用10ml饱和食盐水洗涤后,再每次用10ml饱和氯化钙溶液洗涤两次,弃去下层水相,酯层自漏斗上口倒入干燥的锥形瓶中,用无水碳酸钾干燥。
将干燥好的粗乙酸乙酯小心倾入60ml的梨形蒸馏瓶中(不要让干燥剂进入瓶中),加入沸石后在水浴上进行蒸馏,收集73—80℃的馏分。产品5—8g。
七、操作要点及说明
1、本实验一方面加入过量乙醇,另一方面在反应过程中不断蒸出产物,促进平衡向生成脂的方向移动。乙酸乙酯和水、乙醇形成二元或三元共沸混合物,共沸点都比原料的沸点低,故可在反应过程中不断将其蒸出。这些共沸物的组成和沸点如下:
共沸物组成 共沸点
(1)乙酸乙酯91.9%,水8.1% 70.4℃
(2)乙酸乙酯69.0%,乙醇31.0% 71.8℃
(3)乙酸乙酯82.6%,乙醇8.4%,水9.0% 70.2℃
最低共沸物是三元共沸物,其共沸点为70.2℃,二元共沸物的共沸点为70.4℃和71.8℃,三者很接近。蒸出来的可能是二元组成和三元组成的混合物。加过量48%的乙醇,一方面使乙酸转化率提高,另一方面可使产物乙酸乙酯大部分蒸出或全部蒸出反应体系,进一步促进乙酸的转化,即在保证产物以共沸物蒸出时,反应瓶中,仍然是乙醇过量。
2、本实验的关键问题是控制酯化反应的温度和滴加速度。控制反应温度在120℃左右。温度过低,酯化反应不完全;温度过高(>140℃),易发生醇脱水和氧化等副反应:
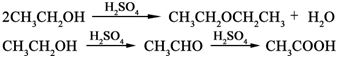
故要严格控制反应温度。
要正确控制滴加速度,滴加速度过快,会使大量乙醇来不及发生反应而被蒸出,同时也造成反应混合物温度下降,导致反应速度减慢,从而影响产率;滴加速度过慢,又会浪费时间,影响实验进程。
3、用饱和氯化钙溶液洗涤之前,要用饱和氯化钠溶液洗涤,不可用水代替饱和氯化钠溶液。粗制乙酸乙酯用饱和碳酸钠溶液洗涤之后,脂层中残留少量碳酸钠,若立即用饱和氯化钙溶液洗涤会生成不溶性碳酸钙,往往呈絮状物存在于溶液中,使分液漏斗堵塞,所以在用饱和氯化钙溶液洗涤之前,必须用饱和氯化钠溶液洗涤,以便除去残留的碳酸钠。乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g,若用水洗涤,必然会有一定量的脂溶解在水中而造成损失。此外,乙酸乙酯的相对密度(0.9005)与水接近,在水洗后很难立即分层。因此,用水洗涤是不可取的。饱和氯化钠溶液既具有水的性质,又具有盐的性质,一方面它能溶解碳酸钠,从而将其双酯中除去;另一方面它对有机物起盐析作用,使乙酸乙酯在水中的溶解度大降低。除此之外,饱和氯化钠溶液的相对密度较大,在洗涤之后,静置便可分离。因此,用饱和氯化钠溶液洗涤既可减少酯的损失,又可缩短洗涤时间。
4、乙酸乙酯的精制
(1)除乙酸 将馏出液在搅拌的同时慢慢加入饱和碳酸钠溶液,直至不再有二氧化碳气体产生或酯层不显酸性(可用PH试纸检测)为止。
(2)除水份 将混合液转移至分液漏斗中,充分振荡(注意放气)、充分静置后分去下层水溶液。
(3)除碳酸钠 漏斗中的酯层先用10ml饱和食盐水洗涤,静置分层,放去下层溶液。
(4)除乙醇 用饱和氯化钙溶液20ml分两次洗涤酯层。充分振荡后,静置分层,放去下层液,酯层自漏斗上口倒入一干燥的带塞锥形瓶中,加入2~3g无水硫酸钠。不断振荡,待酯层清亮(约15min)后,用折叠滤纸在长颈漏斗中滤入干燥的蒸馏烧瓶中。
(5)除乙醚 在蒸馏烧瓶中加入几粒沸石,在水浴上蒸馏。将35~40℃的馏分(乙醚)倒入指定的容器,收集73~78℃的馏分即为乙酸乙酯,称重,计算产率。
八、注意事项
(1)加料滴管和温度计必须插入反应混合液中,加料滴管的下端离瓶底约5mm为宜。
(2)加浓硫酸时,必须慢慢加入并充分振荡烧瓶,使其与乙醇均匀混合,以免在加热时因局部酸过浓引起有机物碳化等副反应。
(3)反应瓶里的反应温度可用滴加速度来控制。温度接近125℃,适当滴加快点;温度落到接近110℃,可滴加慢点;落到110℃停止滴加;待温度升到110℃以上时,再滴加。
(4)本实验酯的干燥用无水碳酸钾,通常只少干燥半个小时以上,最好放置过夜。但在本实验中,为了节省时间,可放置10分钟左右。由于干燥不完全,可能前馏分多些。
(5)硫酸的用量为醇用量的3%时即能起催化作用。当用量较多时,它又能起脱水作用而增加酯的产率。但过多时,高温时的氧化作用对反应不利。
(6)当采用油浴加热时,油浴的温度约在135℃左右。也可改为小火直接加热法。但反应液的温度必须控制在120℃以下。否则副产物乙醚会最多。
(7)在馏出液中除了醋酸和水外,还含有未反应的少量的乙醇和乙酸。也还有副产物乙醚,故必须用碱来除去其中的酸,并用饱和氯化钙溶液来除去未反应的醇,否则将会影响到酯的产率。
(8)当酯层用碳酸钠洗过后,若紧接着就用氯化钙溶液洗涤,有可能产生絮状的碳酸钙沉淀,使进一步分离变得困难,故在这两步操作之间必须水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以实际上用饱和食盐水来进行水洗。
(9)乙酸乙酯与水或乙醇可分别生成共沸混合物,若三者共存则生成三元共沸混合物。因此,酯层中的乙醇不除净或干燥不够时,由于形成低沸点的共沸混合物,从而影响到酯的产率。
实验交流
共享应用
-
浏览量 9170
-
点赞数 2
-
收藏数 1
课程评分
课程回复
-
评论数 0

