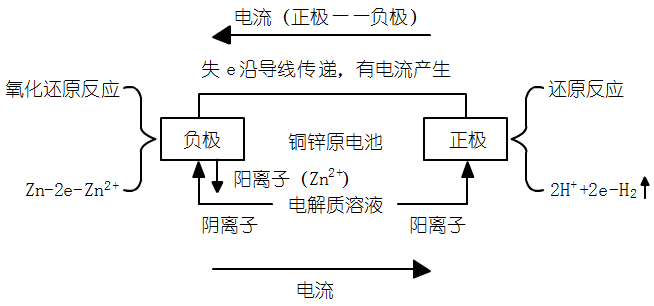
将化学能转变为电能的装置称为原电池。在原电池中,发生的化学反应是氧化还原反应。发生氧化反应的一极上有电子流出,做负极,失去电子的物质是还原剂。电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应。原电池就是通过化学反应实现化学能向电能转化的。
原电池
原电池

实验原理
实验步骤
一、原电池的工作原理
将化学能转变为电能的装置叫做原电池,它的原理是将氧化还原反应中还原剂失去的电子经过导线传给氧化剂,使氧化还原反应分别在两极上进行。
二、原电池的形成条件
1. 活泼性不同的电极材料
2. 电解质溶液
3. 构成闭合电路(用导线连接或直接接触)
4. 自发进行的氧化还原反应
注意:构成原电池的四个条件是相互联系的,电极不一定参加反应,电极材料不一定都是金属,但应为导体,电解质溶液应合理的选取。
三、判断原电池正负极常用的方法
1. 根据电极材料:较活泼一极为负,较不活泼的一极为正(与电解质反应得失电子);
2. 根据两极发生的反应:发生氧化反应的一极为负,还原反应的一极为正;
3. 根据电极增重还是减重:溶解或减轻的一极为负,增加或放出气泡的一极为正; (铅酸电池(Pb-PbO2)可作为经典特例:放电时,由于正极PbO2反应后变为PbSO4,负极Pb反应后也变为PbSO4,重量均有增加,溶液溶质H2SO4有所减少。)
4. 根据电子或电流流动方向:电流方向:正→负;电子流向:负→正;
5. 根据溶液中离子运动方向:阴离子移向的一极为负,阳离子移向的一极为正;
实验交流
共享应用
-
浏览量 3433
-
点赞数 0
-
收藏数 0
课程评分
0
课程回复
-
评论数 0

