酸碱指示剂的选择
酸碱指示剂的选择
酸碱指示剂的选择

实验原理
实验步骤
一、介绍
酸碱指示剂指的是用于酸碱滴定的指示剂,英文名称:acid-base indicator。
酸碱指示剂一般是有机弱酸或弱碱,它们的共轭酸碱对具有不同结构而呈现不同颜色。当溶液的pH改变时,指示剂得到质子,由碱式转变为共轭酸式,或失去质子,由酸式转变为共轭碱式,由于其结构的转变而发生颜色的变化。
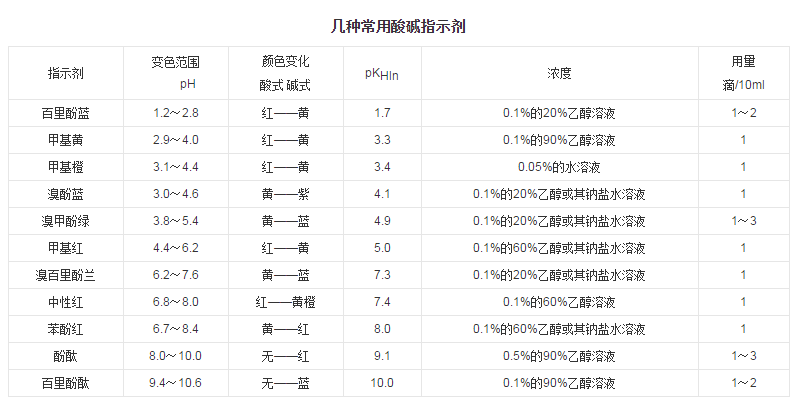
常见的酸碱指示剂

二、示剂分类
1. 硝基酚类 这是一类酸性显著的指示剂,如对-硝基酚等。
2. 酚酞类 有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。
3. 磺代酚酞类 有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。
4. 偶氮化合物类 有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解。
三、用量要求
碱指示剂应该选用甲基橙作指示剂。
1. 双色指示剂的变色范围不受其用量的影响,但因指示剂本身就是酸或碱,指示剂的变色要消耗一定的滴定剂,从而增大测定的误差。对于单色指示剂而言,用量过多,会使用变色范围向pH值减小的方向发生移动,也会增大滴定的误差。例如:用0.1mol/L NaOH滴定0.1mol/L HAc,pH≈8.5,突跃范围为pH8.70~9.00,滴定体积若为50ml,滴入2~3滴酚酞,大约在pH≈9时出现红色;若滴入10~15滴酚酞,则在pH≈8时出现红色。显然后者的滴定误差要大得多。
指示剂用量过多,还会影响变色的敏锐性。例如:以甲基橙为指示剂,用HCl滴定NaOH溶液,终点为橙色,若甲基橙用量过多则终点敏锐性就较差。
2. 温度和溶剂
温度的变化会引起指示剂电离常数和水的质子自递常数发生变化,因而指示剂的变色范围亦随之改变,对碱性指示剂的影响较酸性指示剂更为明显。不同的溶剂具有不同的介电常数和酸碱性,因而也会影响指示剂的电离常数和变色范围。
3. 指示剂的选择
指示剂选择不当,加之肉眼对变色点辨认困难,都会给测定结果带来误差。
因此,在多种指示剂中,选择指示剂的依据是:要选择一种变色范围恰好在滴定曲线的突跃范围之内,或者至少要占滴定曲线突跃范围一部分的指示剂。这样当滴定正好在滴定曲线突跃范围之内结束时,其最大误差不过0.1%,这是容量分析容许的。
四、常用示剂
各种不同的酸碱指示剂,具有不同的变色范围,有的在酸性溶液中变色,如甲基橙、甲基红等;有的在中性附近变色,如中性红、苯酚红等;有的则在碱性溶液中变色,如酚酞、百里酚酞等。几种常用酸碱指示剂及其变色范围列于下表。
实验交流
共享应用
-
浏览量 2812
-
点赞数 0
-
收藏数 0
课程评分
课程回复
-
评论数 0

